プレスリリース
2017年5月26日


国立循環器病研究センター
株式会社国際電気通信基礎技術研究所(ATR)


国立循環器病研究センター
株式会社国際電気通信基礎技術研究所(ATR)
からだに優しいがん転移予防薬の実現に向けて
-がんの信号を抑える心臓ホルモンのメカニズム解明-
-がんの信号を抑える心臓ホルモンのメカニズム解明-
国立循環器病研究センター(大阪府吹田市、理事長:小川久雄、略称:国循)研究所の野尻崇(生化学部ペプチド創薬研究室長)、寒川賢治(研究所担当理事)らの研究グループは、 株式会社国際電気通信基礎技術研究所(京都府相楽郡精華町(けいはんな学研都市)、代表取締役社長:平田康夫、略称:ATR)佐藤匠徳特別研究所河岡慎平主任研究員らのグループ、東京大学および大阪大学との共同研究で、心臓から分泌されるホルモンである心房性ナトリウム利尿ペプチド(Atrial Natriuretic Peptide; ANP)の投与により様々な種類のがんの転移を予防・抑制できること、また、そのメカニズムについて明らかにしました。本研究の成果は、2017年5月26日(米国東部時間5月25日)に科学誌「Oncotarget」のオンライン速報版で公開されます。
本研究では、マウスの乳がんや肺がんモデルを用いて、ANPを投与したときとそうでないときの2通りの場合について、主要な転移先臓器の一つである肺組織の遺伝子発現を網羅的に調べました。これらのがんは、転移する前から、肺の遺伝子発現をがんに都合の良いように変化させることが知られています。約2万種類の遺伝子に対する解析の結果、ANPががんにより増加する肺の遺伝子発現変化をまんべんなく抑制できることがわかりました。驚くべきことに、がんをもたないマウスにANPを投与しても、正常肺にはほとんど影響が認められず、また、ANPはがんの増殖などには影響しませんでした。このことから、ANPががんがあるときに肺に起こる悪影響を特異的に緩和する能力を持つ、“がんストレス緩和ホルモン”であることが示唆されました。さらに、ANPによる転移抑制効果は、血管内皮細胞を介して得られることを証明し、がんストレス緩和における血管の重要性が示されました。現在、ANPによる抗術後転移・抗再発効果を検証するための多施設臨床研究(JANP study;国循が主導)について、肺がん手術500例を対象に実施中です。本論文は、がんによる悪影響から身体を守る新しい制がん剤-からだに優しい転移予防薬-を開発するための基盤情報となることが期待されます。
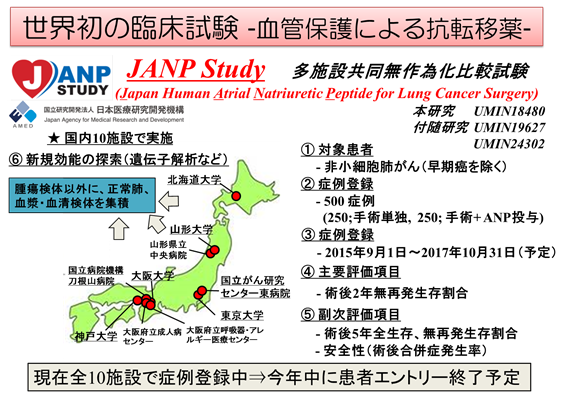
国循主導の肺がん手術を対象とした多施設共同無作為化比較試験(Japan Human Atrial Natriuretic Peptide for Lung Cancer Surgery: JANP study)は、先進医療B承認後2015年9月より開始しており、現在300例以上の症例登録が完了しています。2016年4月より日本医療研究開発機構(AMED)の「臨床研究・治験推進研究事業」に採択・支援を受けています。参加施設は、大阪大学医学部附属病院、東京大学医学部附属病院、北海道大学病院、山形大学医学部附属病院、神戸大学医学部附属病院、国立がんセンター東病院、国立病院機構刀根山病院、大阪国際がんセンター、大阪はびきの医療センター、山形県立中央病院の10施設です。
◆研究の背景
ANPは、1984年に寒川賢治、松尾壽之(当センター名誉研究所長)らによって発見された心臓ホルモンであり、現在心不全に対する治療薬として臨床で使用されています。
これまでに我々のグループでは、肺がん手術の際、手術中より3日間ANPを投与することによって、様々な術後合併症だけでなく、肺がんの再発を予防できることを報告しました。再発予防のメカニズムとして、ANPが血管内皮細胞のEセレクチンという接着分子の発現を抑え、がん細胞が血管に接着するのを防ぎ、その結果、がんの再発を防ぐことを明らかにしてきました。
◆研究手法と成果
結果①‐担がんモデルマウスに対するANPの転移抑制効果
まず、マウス乳がんと大腸がんモデルを作製し、ANP投与群と対照群に分けて4週間観察したところ、がん病巣の大きさには変化がなかったものの、肺転移個数はANP群で明らかに少ない結果でした。つまり、ANPはがん病巣の大きさを減らすことができなくとも、転移を抑えることができることが示されました。
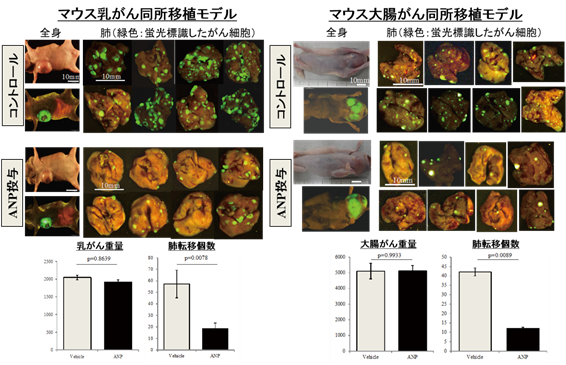
結果②‐がん転移より先に、転移予定先臓器で炎症がまず起きる“転移前土壌形成”
乳がん細胞をマウスに移植すると、数週間で血行性肺転移が起こります。注目すべきは、肺転移が生じる前に(移植後数日で)転移先の肺において様々な炎症が生じる現象です。本現象は、がんによる“転移前土壌形成”と呼ばれ、がんが自身に都合の良いように正常臓器に状態を変化させると考えられています。研究グループは、約2万種類の網羅的遺伝子解析を行い、肺の遺伝子発現変化として捉えられる転移前土壌形成に対するANPの効果について検討しました。その結果、がん移植後7日目のマウスの肺では、様々な(主に炎症に関わる)遺伝子発現が増加し、転移前土壌の形成が認められましたが、ANPを投与することにより、このような遺伝子発現の増加を広く抑えることができました。興味深いことに、がんを持たない正常なマウスにANPを投与しても、肺の遺伝子発現を大きく変える作用はありませんでした。このことから、ANPが正常な肺を傷つけずに、がんがある状態で大きな効果を発揮するホルモンであることがわかりました。これらの結果に基づき我々は、ANPががんによる肺への悪影響、すなわちがんによるストレスを防ぐ“がんストレス緩和ホルモン”としての機能を持つと考えています。また、ANPの上記作用について、肺がんでも同様の結果であることを確認しました。
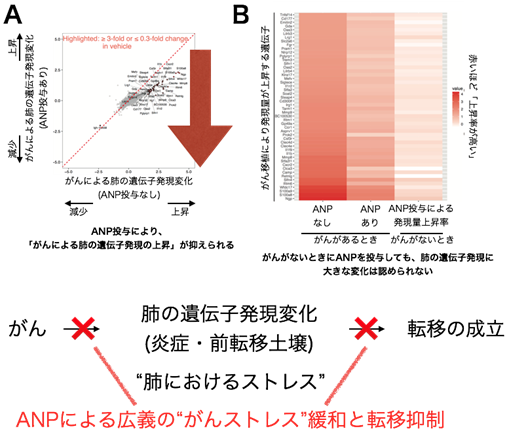
結果③‐ANPによるがんストレス緩和効果は血管を介して発揮される(遺伝子改変マウスを用いた実験)
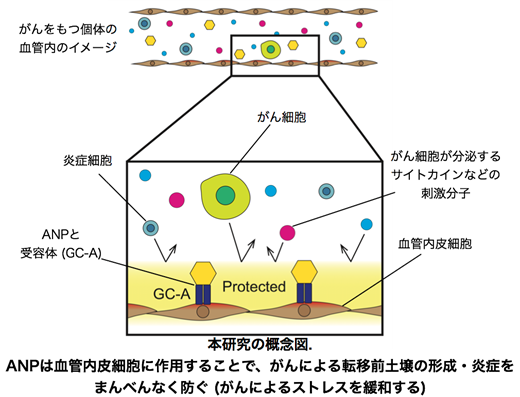
ANPがどのようにがんストレス緩和効果を発揮しているのか調べる為に、ANPの受容体遺伝子(GC-A)を血管内皮細胞で特異的に過剰に発現させたマウスを用いた実験を行いました。本マウスでは、ANPの作用が増強される為、ANPを薬理的に投与したことと同様の効果が見られることが知られています。すると、血管内皮細胞を介したANP経路の活性化は、がんを持たない状態の肺の遺伝子発現にはほとんど影響せず、がんがある場合でのみ、がんによる遺伝子発現の変化を広く抑える効果があることがわかりました。また、ANPを外から投与した場合と、ANPが血管だけ効くマウスの遺伝子発現変化について比較したところ、両群の効果がほぼ一致していたことから、ANPは、血管を介して“がんストレス緩和ホルモン”としての効果を発揮したことがわかりました。
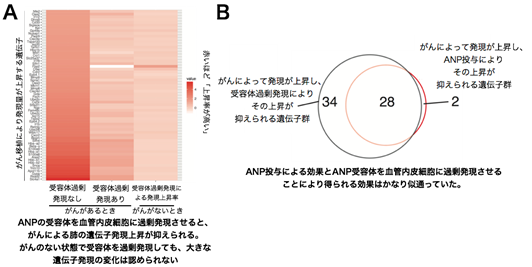
以上まとめると、今回の研究では、ANPが
①正常な肺に悪影響を及ぼさないこと。
②がんによるストレスを特異的かつまんべんなく抑制できること。
③ “がんストレス緩和”作用は、主に血管を介した作用であること。
の3点が明らかとなりました。
◆今後の展望
現在日本人の“2人に1人はがんになり、3人に1人が、がんで死亡する”時代です。近年、新薬が多く登場しており、がん治療は大きな進歩を遂げています。しかしながら現在でも、がん細胞自体を攻撃する抗がん剤が主体的であり、問題点として、がんの種類によって効果のある抗がん剤が違うこと、また同じがんの種類であっても、個人によって効果のある抗がん剤が違うことが挙げられます。さらに、がん患者さんは、全身へがんが転移することで余命が短くなりますが、これまでにがんの転移を防ぐ薬(抗転移薬)は開発されておりません。
今回の研究では、ANPという、我々がもともと体内に持っているホルモンの働きを増強することで、血管を介してがんストレスを緩和できる可能性が示唆されました。また、ANPによるがんストレス・転移緩和効果は、乳がん、肺がん、大腸がんといった様々な種類のがんに対して発揮されることも示されました。ANPによるがんストレス・転移抑制効果に基づく治療法は、今後多くのがん治療へ応用されることが期待されます。また、転移は、がんによる死亡の主要な原因であると考えられています。転移さえ防ぐことができれば、がんを持ったまま天寿を全うできるような時代が来るかもしれません。
ANPは1995年の発売以来、数十万人の心不全患者に使用されておりますが、重篤な副作用は知られていません。心臓ホルモンは、誰もが元々持っているので、安全性が高く、副作用の強い従来の抗がん剤よりも使用しやすい点が大きな利点です。ANPをからだに優しい新しいタイプの転移予防薬として役立てる臨床研究は、国立循環器病センターが主導する形で積極的に推進されています。実際、ANPの血管保護による“抗転移薬・抗再発薬”としてのコンセプト実証試験として、国循主導の肺がん手術を対象とした多施設共同無作為化比較試験(JANP study)が500名の肺がん手術を対象として進行中であり、今後様々ながんで実施予定となっています。
<論文タイトル>
"Transcriptome analysis reveals a role for the endothelial ANP-GC-A signaling in interfering with pre-metastatic niche formation by solid cancers"
Oncotarget
著者: Takashi Nojiri (国立循環器病研究センター・大阪大学), Miki Arai (ATR/東京大学)、Yutaka Suzuki (東京大学)、Motofumi Kumazoe (国立循環器病研究センター), Takeshi Tokudome (国立循環器病研究センター), Koichi Miura (国立循環器病研究センター),Jun Hino (国立循環器病研究センター), Hiroshi Hosoda (国立循環器病研究センター), Mikiya Miyazato (国立循環器病研究センター), Meinoshin Okumura (大阪大学), Shinpei Kawaoka (ATR), Kenji Kangawa (国立循環器病研究センター)
本研究は国立循環器病研究センター、ATR、東京大学、大阪大学の共同で行われました。
【お問い合わせ】
国立循環器病研究センター (代表)06-6833-5012
(研究に関すること)研究担当理事 寒川賢治
研究所生化学部ペプチド創薬研究室長 野尻崇
(その他)総務課広報係 星、中野
国際電気通信基礎技術研究所 (代表)0774-95-1111
(研究に関すること)佐藤匠徳特別研究所 河岡慎平
(その他)経営統括部 企画・広報チーム 辰巳
国立循環器病研究センター (代表)06-6833-5012
(研究に関すること)研究担当理事 寒川賢治
研究所生化学部ペプチド創薬研究室長 野尻崇
(その他)総務課広報係 星、中野
国際電気通信基礎技術研究所 (代表)0774-95-1111
(研究に関すること)佐藤匠徳特別研究所 河岡慎平
(その他)経営統括部 企画・広報チーム 辰巳

